実験室
遺伝子解析によるC型肝炎治療効果予測
第一内科肝臓グループでは、肝炎ウイルスと肝炎の病態の関連に関して、特にウイルスゲノムの配列に注目して、研究を行ってきました。
ここではC型肝炎ウイルスの配列と抗ウイルス剤の関連について私たちが行ってきた研究の一端をご紹介します。
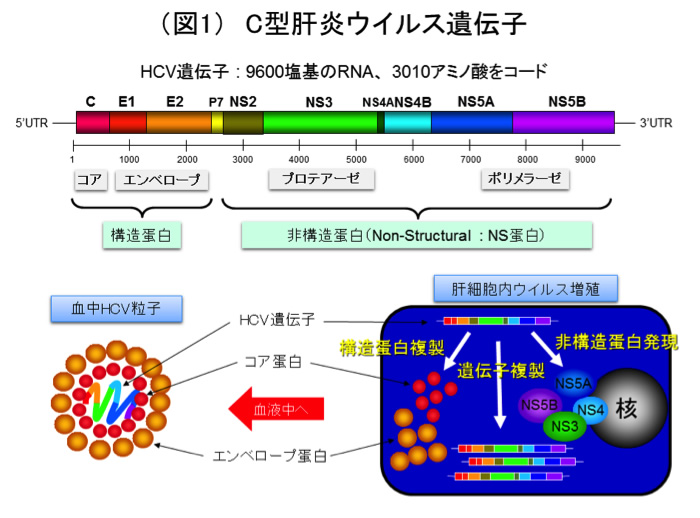
C型肝炎ウイルス(hepatitis C virus, HCV)はプラス一本鎖のRNAウイルスであり(図1)、構造領域からはウイルスの粒子を形づくる構造タンパク、非構造領域からはウイルスRNA複製に必要な酵素蛋白が作られます。HCVは非常に変異しやすいウイルスで、一人の患者さんのなかでもどんどん変異してゆき、変異体の集合状態となって存在しています。この状態をquasispecies(クエーサイ・スピーシーズ)といいます。
HCV変異体の集合体は、特定の環境下で生存に有利なウイルスを供給するプールとなります。
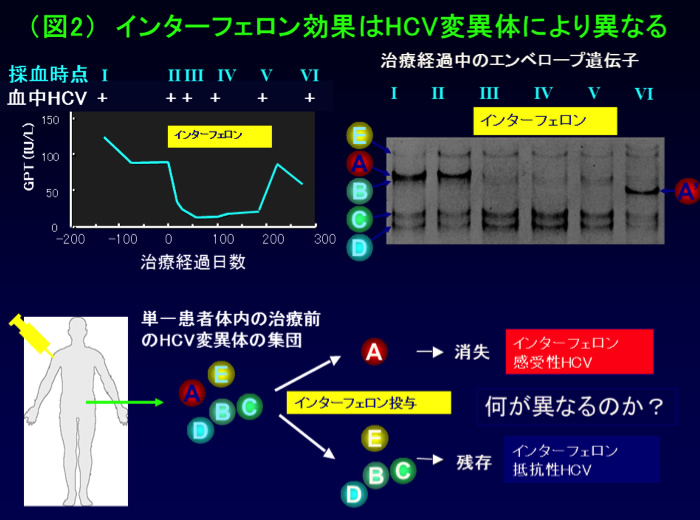
前述したように、患者さんの中ではHCVは変異体の集団として存在します。私たちは抗ウイルス剤であるインターフェロン投与に対する治療反応性の異なるHCVが混在している症例を経験しました(図2)。
すなわちPCR-SSCP法という方法を使って変異体の集合状態を調べると(図2右上)、インターフェロン投与後に(A)は消失したものの、(B),(C),(D),(E)は残存していることがわかりました。
(A)と(B)(C)(D)(E)は、何が違うのでしょうか?
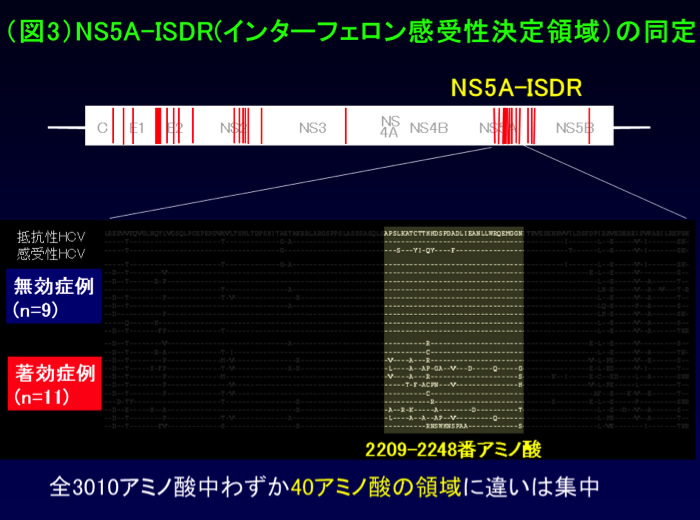
そこで私たちは(A)と(A)以外の違いが、HCVのどの領域にあるのか、明らかにするために、ウイルスの全領域のアミノ酸配列を調べました。そうしますと、約3000アミノ酸の中で、NS5A領域の中のわずか40アミノ酸において、配列の違いが集中していることがわかり、ここをISDR(インターフェロン感受性決定領域)と名付けました(図3)。その後沢山の症例において、検討してもインターフェロンで消失するウイルスは、殆どがISDRに変異が沢山入っており、残存する場合は変異が殆どないことが追認されました。
これらのことから、インターフェロンの治療効果は、治療前のISDR配列を調べておくことで正しく予想することが可能となったのです(1)。
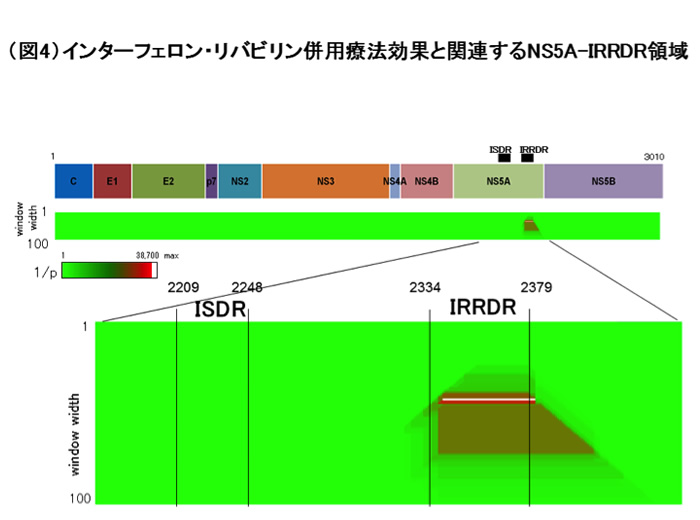
一方、抗ウイルス治療はその後進歩し、インターフェロン・リバビリン併用療法が登場しました。インターフェロン・リバビリン併用療法はインターフェロン単独療法時代と比較して、治療効果が高まりましたが、やはり抵抗性となるものが存在します。わたしたちは、やはりウイルスの全アミノ酸領域を決定し、治療効果を決める領域を探したところ、インターフェロン・リバビリン併用療法では、ISDRのすぐ後ろに存在するNS5A-IRRDR(インターフェロン・リバビリン治療効果決定領域)における変異が規定していることを示しました(図4)(2)。
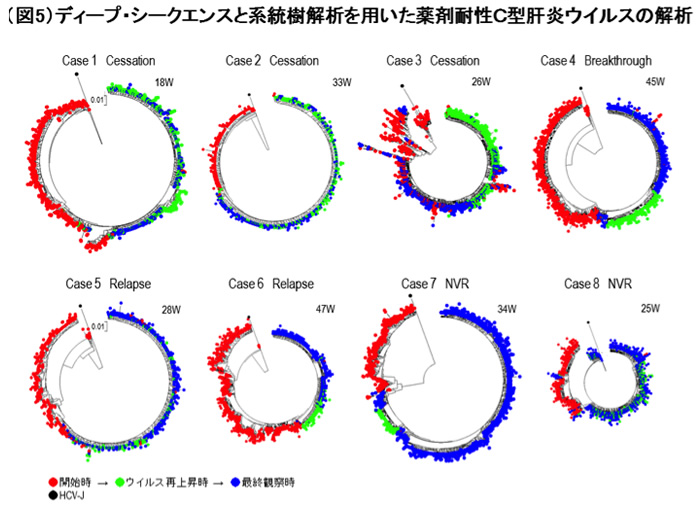
現在は、抗ウイルス剤はさらに進歩し、直接抗ウイルス剤(direct antiviral agent, DAA)と呼ばれる低分子化合物が治療の主体となっています。DAAによって、大半のHCVは排除することが可能となりましたが、一部の症例ではDAA耐性HCVが残存することがあります。私たちは次世代シークエンサーと呼ばれる、数千から数万のウイルス配列を一度に決めることの可能な新しい機器を使って解析し、たくさんのウイルス変異体のなかから、どのHCV変異体が経過とともに変化し、耐性となってゆくのか明らかにしています(図5)(3)。
C型肝炎に関して抗ウイルス療法は、このように大きく進歩していきましたが、未だ患者さん全員のHCVが排除されるわけではなく、またウイルス排除されても十分に肝癌が減らないなどの問題が残されています。
引き続き私たちは、使命感をもってこの問題に取り組んでいきます。
- Enomoto N, Sakuma I, Asahina Y, Kurosaki M, Murakami T, Yamamoto C, Ogura Y, et al. Mutations in the nonstructural protein 5A gene and response to interferon in patients with chronic hepatitis C virus 1b infection. N Engl J Med 1996;334:77-81.
- Maekawa S, Sakamoto M, Miura M, Kadokura M, Sueki R, Komase K, Shindo H, et al. Comprehensive analysis for viral elements and interleukin-28B polymorphisms in response to pegylated interferon plus ribavirin therapy in hepatitis C virus 1B infection. Hepatology 2012;56:1611-1621.
- Sato M, Maekawa S, Komatsu N, Tatsumi A, Miura M, Muraoka M, Suzuki Y, et al. Deep sequencing and phylogenetic analysis of variants resistant to interferon-based protease inhibitor therapy in chronic hepatitis induced by genotype 1b hepatitis C virus. J Virol 2015;89:6105-6116.
(文責:前川伸哉)
レーザーキャプチャーマイクロダイゼクションと次世代シークエンサーを組み合わせた消化器癌遺伝子解析
近年遺伝子解析技術が発達し、従来は困難であった微量な検体からも複数の遺伝子変化を検出することが可能となりました。我々の教室では、患者様から同意を得て頂いた試料あるいは診断や治療で余った資料などからDNAやRNAを抽出し、次世代シークエンサーによる網羅的遺伝子解析を行っております。これらの遺伝子データと臨床情報を合わせて解析し、消化器疾患の病態解明やより良い診断・治療法の開発を目指しております。
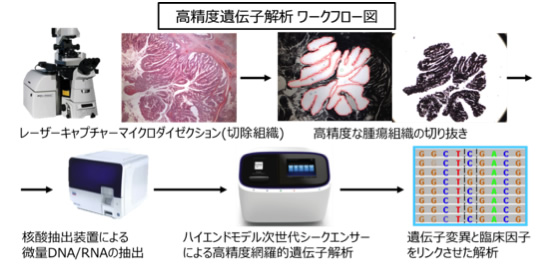
研究には臨床研究、基礎研究、臨床と基礎を融合させたトランスレーショナルリサーチが存在すると思いますが、臨床医である我々は基礎研究のみに没頭して臨床の 技術を低下させるわけにはいきません。臨床研究を通して臨床の技術を磨きつつ、基礎研究となる遺伝子解析を臨床と融合させることで、将来臨床に有用となる新しい知見を得ることを目指しております。このような研究は基礎研究者には不可能であり、豊富な臨床情報と臨床検体を持つ我々のみが可能な研究です。
(研究成果)
(1) 肝臓癌
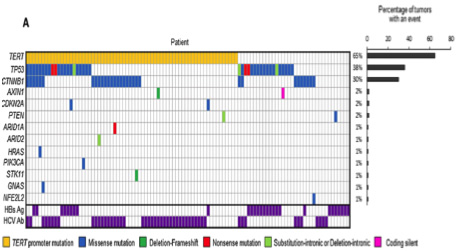
① 肝細胞癌104例の切除組織を用い、得られた遺伝子変異と臨床因子の関連を解析した。
② 肝細胞癌で最も異常が見られた遺伝子変化はTERT (65%)で、TP53 (38%), CTNNB1 (30%)がこれに続いた。
(肝細胞癌104例での遺伝子変異一覧)
③ 臨床背景との関連で見ると、TERT promoterの変異はC型肝硬変患者からの肝細胞癌に有意に多く見られた。TP53変異はB型肝硬変患者からの肝細胞癌で有意に多く見られ、CTNNB1変異はB型肝硬変以外の症例で多く見られた。
④ 予後及び無再発生存期間と遺伝子変異の関連をみると、TERT promoterに変異を有する症例では有意に予後および無再発生存期間が不良であり、これらの遺伝子背景を考慮することで予後の予測、治療強度の選択が今後可能になると考えられる。
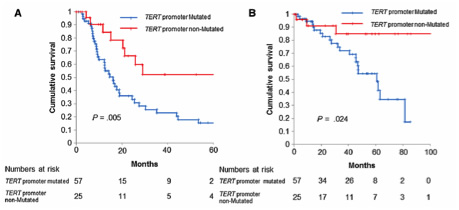
(TERT変異と無再発生存期間、全生存期間)
(2) 膵腫瘍
① 膵管内乳頭粘液性腫瘍 (IPMN)の良悪性診断を膵液の遺伝子解析で行うことを試みた。対象はIPMN切除50例と膵液19検体。遺伝子はIPMNで高頻度にみられると既に報告されているGNAS, KRAS, RNF43を含む52遺伝子を検索した。
② IPMN切除例の遺伝子解析から、KRAS (88%), GNAS (76%), TP53 (34%), RNF43 (30%), SMAD4 (18%), KMT2C (18%)が変異として検出された。切除例の臨床背景と遺伝子解析の結果から、悪性IPMNでみられる遺伝子変異マーカーとして、多変量解析からTP53が有意なものとして同定された。
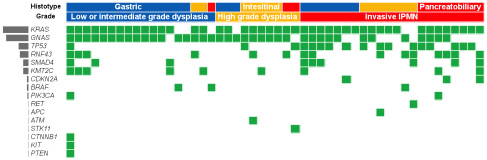
(IPMN50例で検出された遺伝子変異一覧)
③ 切除症例とペアになった19例の膵液で、悪性マーカーであるTP53が検出可能か検討した。良性例では変異は検出されず悪性例の5例で切除組織からTP53変異が検出されていたが、このうち4例から切除組織と同じパターンのTP53変異を検出可能であった。
④ 今後、画像のみでは診断しきれない悪性IPMNを膵液の遺伝子解析で診断することを目標として研究を継続していく予定。
(3) 早期消化管癌(食道癌・胃癌)
① 日本では癌とされている早期食道癌や早期胃癌は内視鏡的粘膜下層剥離術で治療対象となっているが、欧米ではそもそも癌とは定義されておらず高度異形と分類されている。これらの遺伝子背景を解析することで、進行癌へのpotentialを推測することを目的として研究を遂行した。
② 内視鏡的に切除した早期食道癌55例および早期胃癌29例(31病変)を対象とし、50の癌関連遺伝子を解析した。早期食道癌の86%、早期胃癌の77%でTP53変異が検出された。進行癌でも高頻度にTP53変異が見られることが報告されており、また非癌部ではこれらの変異は検出されないことから、今回対象とした早期病変は進行癌に至るpotentialを有していると推測される。
③ 臨床因子との関連では、早期食道癌で見られたTP53変異は飲酒や喫煙以外の要因との関連が示唆され、また早期胃癌で見られるTP53変異はヘリコバクターピロリ菌感染との関連が示唆された。
(文責:高野伸一)